RhD-Varianten: Mehr als (nur) positiv und negativ
Das RhD-Merkmal („Rhesusfaktor“) ist nach den AB0-Merkmalen die wichtigste und klinisch relevanteste Blutgruppeneigenschaft. Ursächlich hierfür ist u. a. die starke Immunogenität dieses Merkmals, d. h. die Fähigkeit, bei RhD-negativen Menschen die Bildung eines Antikörpers gegen RhD, das Anti-D, zu induzieren. Anti-D ist transfusions- und geburtsmedizinisch von hoher Relevanz, da Anti-D Transfusionsreaktionen und einen Morbus haemolyticus neonatorum (MHN) verursachen kann.
DR. MED. LUKAS WAGNER
Etwa 15 % der Bevölkerung in Mitteleuropa weisen das RhD-Merkmal nicht auf – sie sind RhD-negativ. Diesen stehen ca. 85 % der Bevölkerung gegenüber, die RhD-positiv sind.
Aufgrund der hohen Relevanz einer Anti-D Bildung soll diese im klinischen Kontext nach Möglichkeit vermieden werden. Daher erfolgen Transfusionen von z. B. Erythrozytenkonzentraten meist RhD-gleich, wobei die Versorgung mit RhD-negativen Konserven aufgrund der geringen Verfügbarkeit ein fortwährendes Problem darstellt. Eine RhD-Sensibilisierung bei RhD-negativen Schwangeren kann durch die Gabe einer Rhesusprophylaxe zuverlässig verhindert werden. Die präpartale Rh-Prophylaxe erfolgt seit Ende 2020 gezielt nur im Falle eines RHD-positiven Kindes nach vorheriger, fetaler RHD-Typisierung mittels nicht-invasiven Pränataltests (siehe auch Labor 28 Magazin #65, Artikel 5).
Ein kleiner Teil der Bevölkerung fügt sich allerdings nicht in das dichotome Bild von RhD-positiv und RhD-negativ: Bei ca. 0,2 bis 0,5 % der Menschen findet sich in Deutschland ein quantitativ abgeschwächtes und/oder qualitativ verändertes RhD-Merkmal (siehe Abb. 1). Man spricht hierbei von RhD-Varianten.
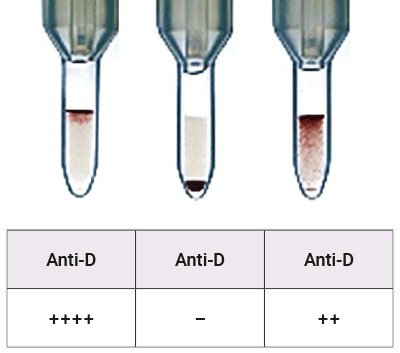
Abbildung 1: Serologische RhD-Bestimmung im Gelkartensystem (Bio-Rad®): RhD-positiv (l.), RhD-negativ (m.), RhD-Variante (r.)
Als SpenderInnen gelten alle RhD-Varianten als RhD-positiv, da sie zumindest einige Epitope des RhD-Proteins aufweisen. Die Bewertung als EmpfängerIn bzw. Schwangere gestaltet sich hingegen komplizierter:
Das RhD-Merkmal ist ein Protein, das als Transmembranprotein der Erythrozyten vom RHD-Gen kodiert wird (siehe Abb. 2). Jede (nicht-synonyme) Mutation in den kodierenden Bereichen des RHD-Gens führt somit zu einem veränderten RhD-Protein. Durch die veränderte Proteinstruktur können Epitope des normalen RhD-Proteins verloren gehen. In diesem Fall können TrägerInnen dieser Variante Antikörper gegen die ihnen fehlenden Epitope bilden, wenn sie mit einem normalen RhD-Protein in Kontakt kommen. Bei diesen PatientInnen sollte daher eine Versorgung mit RhD-negativem Blut erfolgen und Schwangere sollten eine Rh-Prophylaxe erhalten.
In der Anfangsphase der Erforschung der RhD-Varianten seit Mitte des letzten Jahrhunderts erfolgte die Differenzierung mit serologischen Methoden, und es entwickelte sich eine mitunter uneindeutige und verwirrende Nomenklatur. Auch die klare Zuordnung zu einer bestimmten Entität war mit den serologischen Methoden nicht immer möglich, was die Erforschung erschwerte. Der Vollständigkeit halber sei erwähnt, dass die Varianten aktuell auf Basis serologischer und immungenetischer Eigenschaften in weak D Typen, sowie die Partial D- und DEL-Phänotypen eingeteilt werden.
Um die Jahrtausendwende kam mit der molekulargenetischen Untersuchung des RHD-Gens (RHD-Genotypisierung) der Durchbruch in der Forschung. Durch die eindeutige Gensequenz konnten Entitäten klar voneinander abgegrenzt und die Untersuchungen bzgl. einer möglichen Sensibilisierung auf eine solide Datenbasis gestellt werden.
Auch wenn die RhD-Varianten insgesamt verhältnismäßig selten vorkommen, so werden ca. 90 % von ihnen hierzulande durch die weak D Typen 1, 2 und 3 verursacht. Aufgrund ihrer relativen Häufigkeit konnte bereits vor der Ära der Molekulargenetik erkannt werden, dass bei Vorliegen einer dieser drei Varianten keine RhD-Sensibilisierung erfolgt. EmpfängerInnen mit den weak D Typen 1, 2 und 3 gelten daher als RhD-positiv und können mit RhD-positiven Blutprodukten versorgt werden. Eine Rhesusprophylaxe ist bei Schwangeren mit diesen Genotypen nicht erforderlich.
TrägerInnen aller anderen RhD-Varianten gelten hingegen nach aktuellem Stand der Wissenschaft als EmpfängerInnen bzw. in der Schwangerschaft als RhD-negativ. Bei einigen dieser Varianten konnte bereits gezeigt werden, dass eine RhD-Sensibilisierung möglich ist (z. B. bei den meisten Partial D-Phänotypen oder den weak D Typen 4.2, 15 und 33). Bei den anderen liegen diesbezüglich hingegen (u. a. aufgrund ihrer Seltenheit) noch keine ausreichenden Informationen vor.
Welche praktischen Konsequenzen ergeben sich aus obigen Erläuterungen?
Durch die molekulargenetische Untersuchung kann bei abgeschwächter RhD-Expression in ca. 90 % der Fälle in Deutschland ein weak D Typ 1, 2 oder 3 nachgewiesen werden. Da diese PatientInnen als EmpfängerInnen als RhD-positiv gelten (s. o.), können hierdurch wertvolle RhD-negative Konserven geschont werden. Zudem vereinfacht sich die Versorgung mit Blutprodukten und bei Schwangeren werden unnötige Gaben einer Rh-Prophylaxe vermieden. Seit September 2021 erfolgt die RHD-Genotypisierung im Labor 28.
Dennoch ist die RHD-Genotypisierung nicht generell bei Nachweis einer abgeschwächten RhD-Expression empfohlen. Gemäß aktueller „Richtlinie Hämotherapie (Gesamtnovelle 2017)“ soll die Genotypisierung „insbesondere bei Mädchen, bei gebärfähigen Frauen und bei Patienten mit chronischem Transfusionsbedarf“ erfolgen.
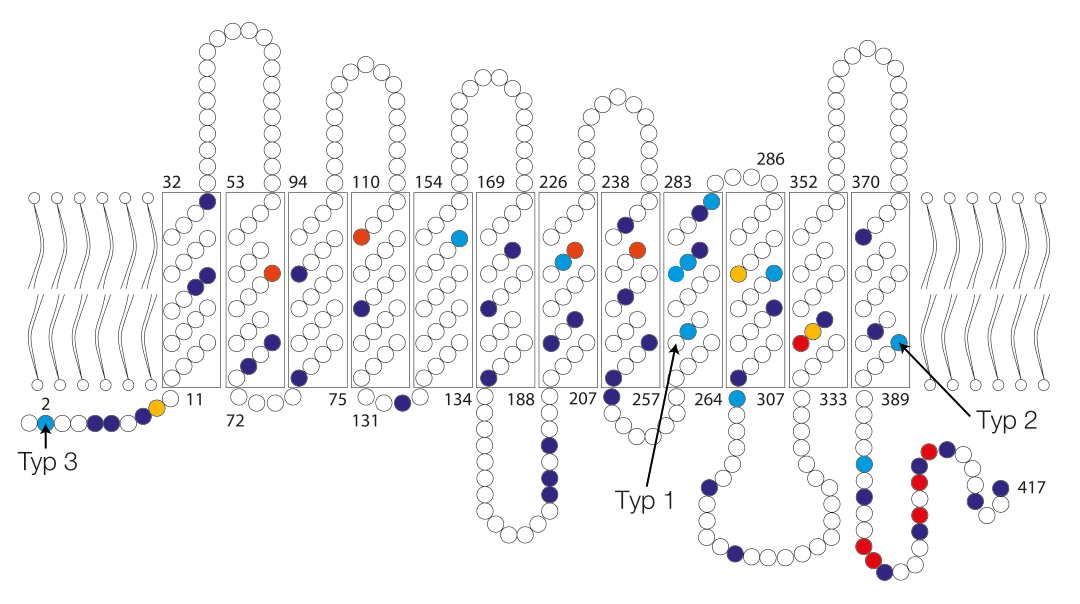
Abbildung 2: Schematische Darstellung des RhD-Proteins in der Erythrozytenmembran. Aminosäureveränderungen, die zu RhD-Varianten (weak D Typen) führen, sind farbig markiert. Mit freundlicher Genehmigung adaptiert aus „Molekulare Diagnostik in der Immunhämatologie“ in hämotherapie, 25/2015, Seite 4–21.
Literatur
- Friesen J, Neuber R, Fuhrmann J, Kietzmann H, Wenzel T, Schaumburg F, Müller M, Ignatius R. Panton-Valentine-leukocidin-positive Staphylococcus aureus in skin and soft tissue infections from primary care patients. Clin Microbiol Infect. 2020 Oct; 26(10):1416.e1-1416.e4. doi: 10.1016/j.cmi.2020.06.029.

